南湖新闻网讯(通讯员 晏翎)7月19日,国际学术期刊《Nature Communications》在线发表了我校生命科学技术学院刘主教授课题组关于VASH2/SVBP复合物结构和功能的最新研究进展,论文以“Structural basis of tubulin detyrosination by VASH2/SVBP heterodimer”为题,阐明了VASH2/SVBP复合物切割微管蛋白C末端酪氨酸的分子机制。
微管蛋白是真核细胞骨架的关键组分,与细胞功能密切相关。微管蛋白在一系列酶的作用下进行翻译后修饰,复杂、多样的翻译后修饰调控微管蛋白与微管结合蛋白的相互作用,进而帮助微管蛋白实现多样的生物学功能。在众多的翻译后修饰中,微管蛋白的酪氨酸化/去酪氨酸化循环是最早发现的一种可逆的翻译后修饰,与微管功能密切相关。微管蛋白的酪氨酸化/去酪氨酸化循环的失调会导致微管功能的紊乱,与癌症、心肌病、大脑功能障碍等疾病紧密相关。
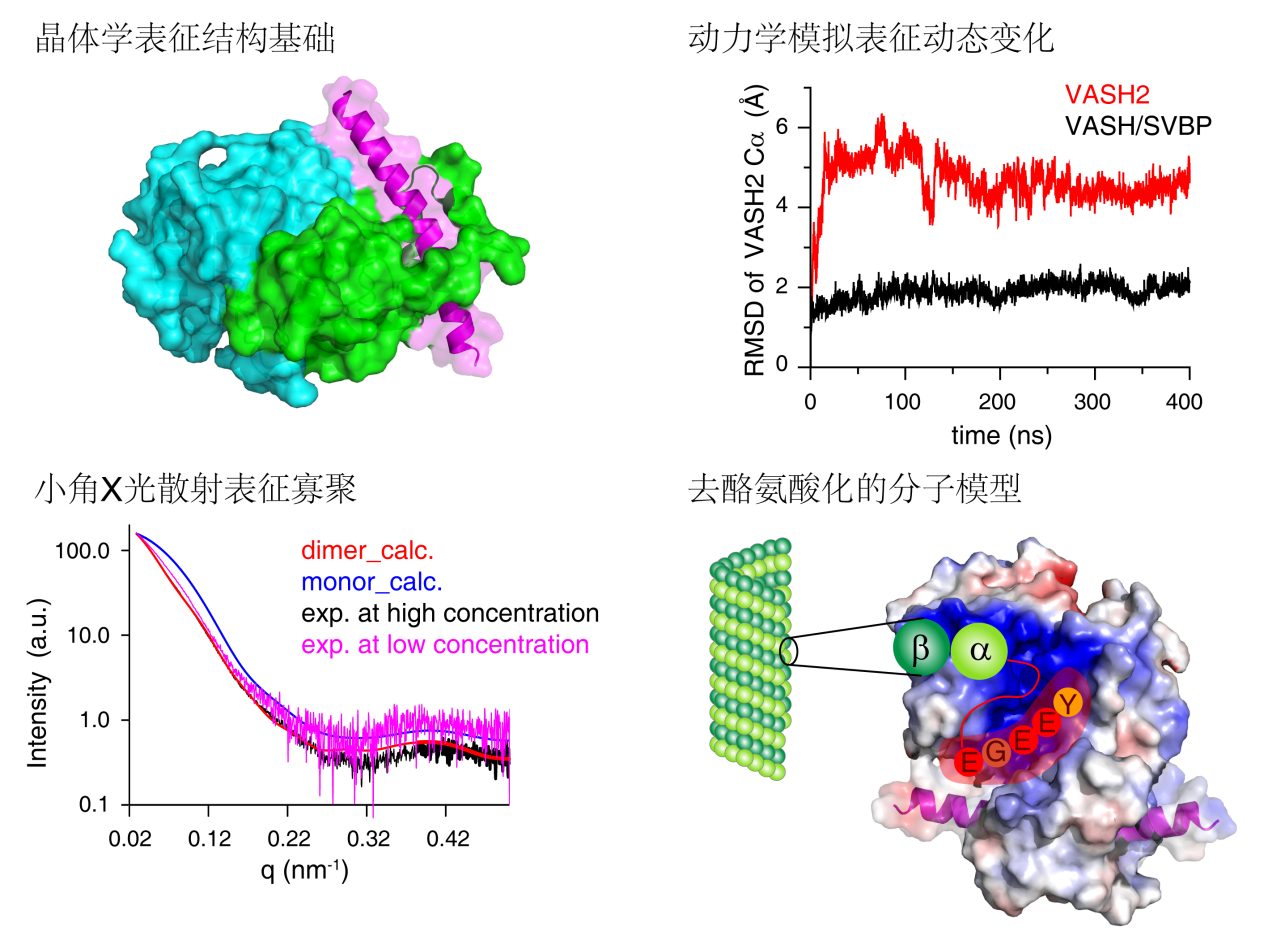
目前,关于微管蛋白的酪氨酸化的分子机制已研究的比较清楚,然而微管蛋白的去酪氨酸化尚不明确。刘主教授的这项研究中,结合晶体学、分子动力学模拟、小角X光散射等多种生物物理手段,深入研究了VASH2/SVBP复合物作用于微管蛋白并对其去酪氨酸化的分子机理。该项工作首先解析了VASH2/SVBP复合物的晶体结构,阐明了去酪氨酸化酶VASH2切割酪氨酸的结构基础;在此基础上,结合分子动力学模拟和生化试验,揭示了SVBP通过稳定VASH2而发挥类似于分子伴侣的功能;结合小角X光散射技术,揭示了VASH2/SVBP复合物弱的寡聚作用,提示该复合物可能通过形成寡聚体来增强与微管的相互作用,提高去酪氨酸化的切割效率。该研究完善了人们对微管蛋白的酪氨酸化/去酪氨酸化循环机制的理解,有助于靶向于微管蛋白去酪氨酸化新药物的设计与开发。
我校生科院博士生周晨和硕士生晏翎为该论文共同第一作者,刘主教授为通讯作者。该工作获得了我校人才启动基金、校自主创新基金以及国家重点研发项目的资助,上海同步辐射光源BL17U1、国家蛋白质科学中心BL19U1和BL19U2线站为晶体衍射数据和小角X光散射收集提供了必要保障。刘主教授特别感谢我校蛋白质平台以及平台张德林副教授,来自平台的硬件与技术支持使得该工作能够快速、顺利开展与完成。
审核人:刘主

已有0人发表了评论