南湖新闻网讯(通讯员 马召玉)近日,我校韩鹤友教授团队与新加坡南洋理工大学赵彦利教授合作,以肝癌为研究对象,针对肿瘤血管梗塞在癌症治疗上的局限性,设计制备了一种肝癌靶向的多功能纳米治疗探针(Th-TPZ@MOF-FA),将血管梗塞治疗与乏氧活化前药治疗相结合,为肿瘤临床术后强化治疗提供了一种新的策略。相关研究成果以“Selective Thrombosis of Tumor for Enhanced Hypoxia-Activated Prodrug Therapy”为题在Advanced Materials发表。
目前,肿瘤治疗的方法主要聚焦在如何杀死肿瘤细胞,但对如何破坏肿瘤相关血管关注的不够,而肿瘤生长和转移都与肿瘤血管密不可分(包括实体瘤和血液恶性肿瘤)。因此,靶向肿瘤血管(或称肿瘤血管阻断)治疗的研究成为当前肿瘤治疗领域的研究热点,极具应用前景。
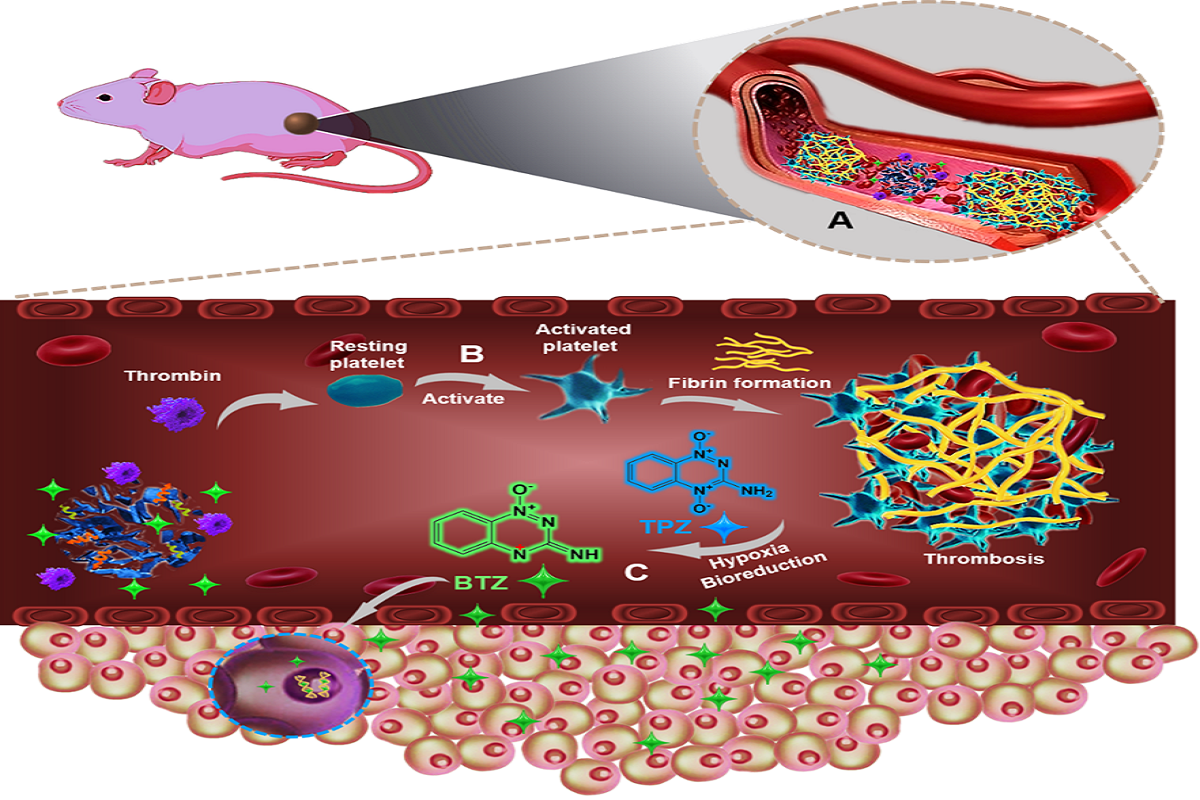
图1. 肿瘤血栓极化乏氧活化前药治疗的示意图
图1所示,血管闭塞可在数小时内发挥作用,迅速诱导血栓形成,单个血凝块足以阻塞用来供养数百个肿瘤细胞的血管,导致肿瘤细胞的缺血性坏死;同时,血管闭塞还降低了肿瘤细胞获得性耐药性的风险。韩鹤友教授团队将凝血酶和替拉扎明TPZ装载在金属有机框架MOF中,并在其表面修饰上带叶酸(FA)的聚乙二醇,制备了一种肝癌靶向的多功能纳米治疗探针(Th-TPZ@MOF-FA)。经尾静脉注射后,Th-TPZ@MOF-FA可靶向并富集到肿瘤部位,数分钟后,肿瘤的微酸环境诱导Th-TPZ@MOF-FA裂解,释放出凝血酶和TPZ,随后释放的凝血酶激活血小板,诱导血红蛋白和纤维蛋白在肿瘤部位形成血栓。肿瘤血管栓塞接着切断肿瘤的主要供氧来源,加剧了乏氧水平,而肿瘤乏氧又成为对该肿瘤进一步治疗并提高治疗效果的新抓手。TPZ是一种很好的乏氧活化前药,在乏氧环境中,它可以产生具有极高细胞毒性的自由基(苯并三嗪基,BTZ),使细胞内DNA断裂并最终导致癌细胞死亡。对于包括肝癌细胞在内的多数癌细胞系,TPZ在乏氧环境中的细胞毒性是有氧环境中毒性的300倍。研究团队将两者结合融为一体,实现了肿瘤的选择性血栓,增强化治疗效果。
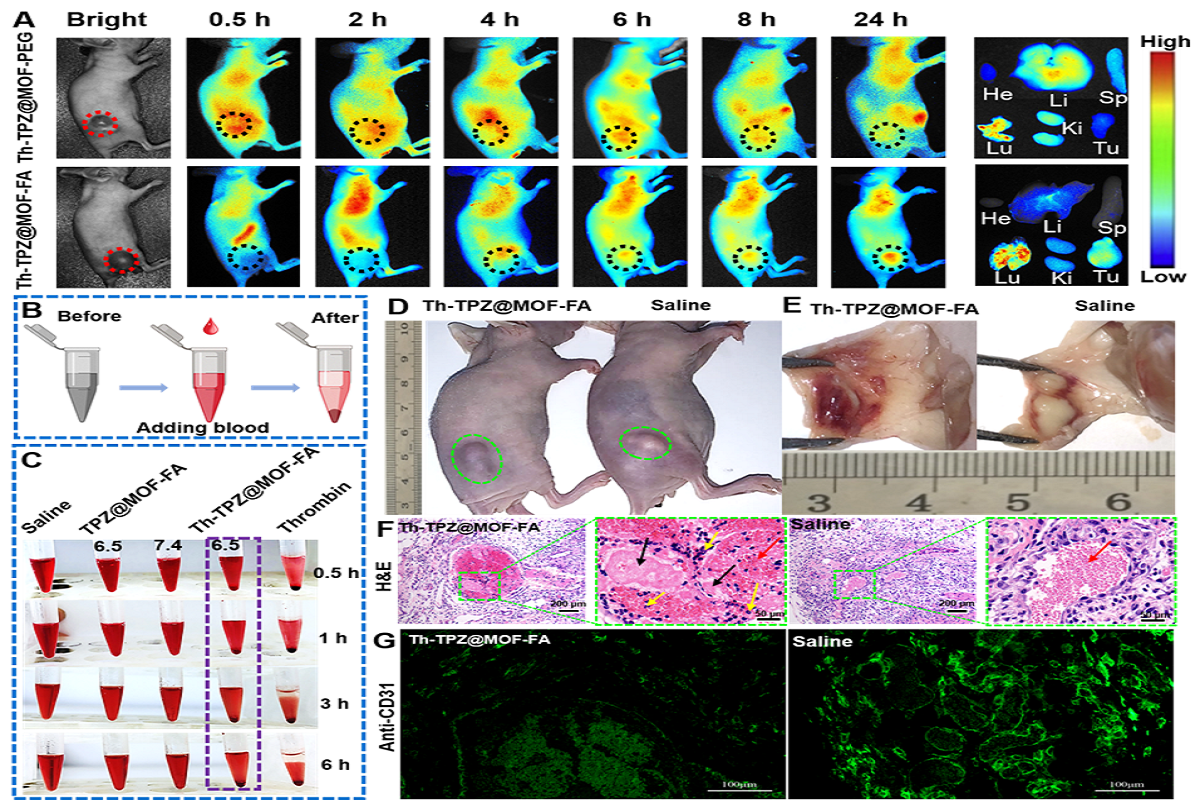
图2. 肿瘤靶向和体内外血栓的生成
如图2所示,纳米治疗探针Th-TPZ@MOF-FA在叶酸的靶向诱导下,可精准地靶向肿瘤部位,并在体外和体内诱导形成血凝块及肿瘤血栓,通过H&E对肿瘤组织病理染色分析,发现材料处理后肿瘤内部形成了明显的血栓,同时用CD31抗体荧光标记血管,发现材料处理后血管明显变稀薄,能有效地抑制血管的生成。这些结果均表明Th-TPZ@MOF-FA能成功地递送凝血酶到肿瘤部位,并通过诱导血栓和抑制抗血管生成来发挥血管阻塞治疗。
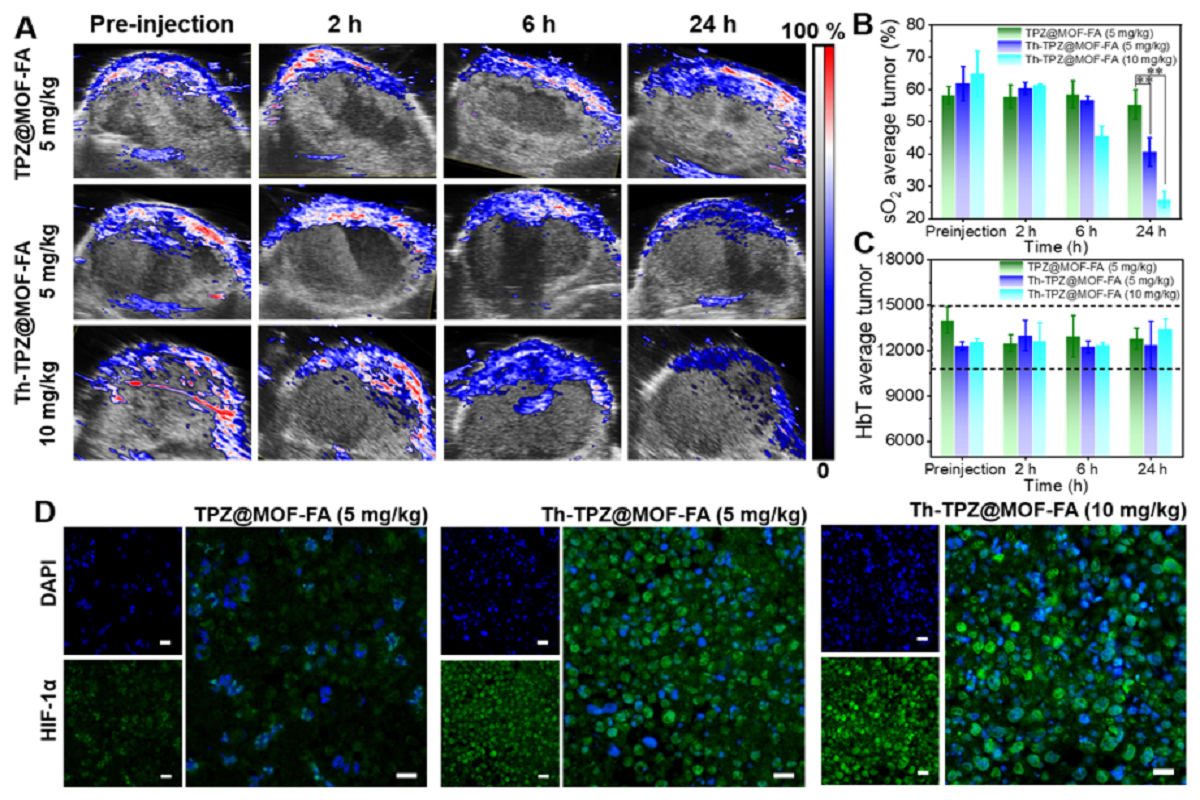
图3.肿瘤乏氧的检测
图3所示,肿瘤血管的阻塞会切断来自血液氧气的供给,导致后续肿瘤部位乏氧加剧。研究团队通过采用活体光声成像来实时监测药物注射后肿瘤部位氧含量的变化,发现随着时间的延长,肿瘤部位氧含量明显降低。除此之外,研究团队还采用HIF-1α(乏氧探针)抗体来标记肿瘤切片,通过对比发现含有凝血酶的Th-TPZ@MOF-FA随着剂量的加大,乏氧的程度也会得到提升。
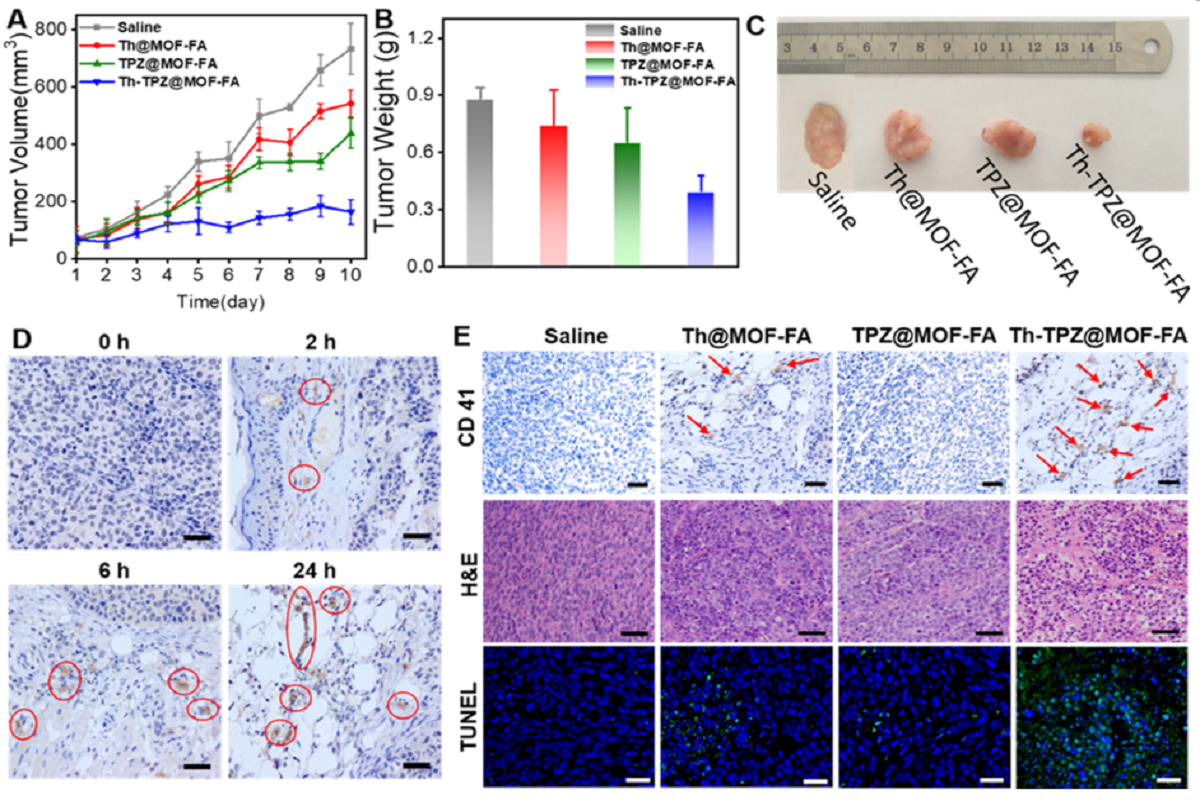
图4.抗肿瘤活性的研究
图4显示,在乏氧环境中,通过对比TPZ可产生的高度活性和细胞毒性自由基(苯并三嗪基,BTZ)对肿瘤生长的抑制结果,可以发现Th-TPZ@MOF-FA的治疗效果最好;同时,在治疗的过程中,我们还通过CD41抗体的免疫组化染色分析实时肿瘤切片,发现肿瘤部位的血栓逐渐形成;治疗结束后,对肿瘤切片进行H&E病理组织染色和TUNEL凋亡免疫荧光染色分析,证实了血管阻塞治疗和乏氧活化前药治疗联合提高了最终的治疗效果。
这种基于血栓治疗肝癌的策略也可以用于其他肿瘤的联合治疗,为肿瘤治疗探索了一种新的路径。
我校博士研究生马召玉为该文章第一作者,我校韩鹤友教授和新加坡南洋理工大学赵彦利教授为该论文的共同通讯作者,我校为成果第一单位。该研究得到了国家自然科学基金等项目的资助。
审核人:韩鹤友
【英文摘要】
One of the main challenges for tumor vascular infarction in combating cancer lies in failing to produce sustained complete thrombosis. Inspired by the capability of vascular infarction in blocking the delivery of oxygen to aggravate tumor hypoxia, the performance of selective tumor thrombus inducing hypoxia activation therapy to improve the therapeutic index of coagulation-based tumor therapy is presented. By encapsulating coagula-tion-inducing protease thrombin and a hypoxia-activated prodrug (HAP) tira-pazamine into metal–organic framework nanoparticles with a tumor-homing ligand, the obtained nanoplatform selectively activates platelet aggregation at the tumor to induce thrombosis and vascular obstruction therapy by the exposed thrombin. Meanwhile, the thrombus can cut o the blood oxygen supply and potentiate the hypoxia levels to enhance the HAP therapy. This strategy not only addresses the dissatisfaction of vascular therapy, but also conquers the dilemma of inadequate hypoxia in HAP treatment. Since clinical operations such as surgery can be used to induce coagulation, coagulation-based synergistic therapy is promising for translation into a clinical combination regimen.
论文连接:
https://onlinelibrary.wiley.com/doi/abs/10.1002/adma.202104504
