南湖新闻网讯(通讯员 官泽源)多聚磷酸盐(polyphosphate, ployP)发现于100多年以前,是生命体中重要的能量代谢物质。PolyP的合成是以ATP为原料,通过形成高能磷酸酐键,将正磷酸盐(Phosphate, Pi)聚合形成线性多聚物,其链长可高达上千个Pi,大量储存能量和Pi。polyP存在于所有生命体,广泛分布于线粒体、细胞核、液泡等细胞器,它通过能量和Pi的可逆储存与释放,维持ATP和Pi稳态,影响多个信号通路,与癌症、神经退行性、细菌感染等疾病相关。
真核生物中,目前唯一已知的polyP合酶是VTC膜蛋白复合物,酵母VTC复合物包含多个亚基(Vtc1, Vtc3, Vtc4等),主要定位于液泡膜。VTC感知磷酸肌醇(PP-InsP)信号,以ATP为原料在胞质侧合成PolyP,并将其跨膜转运至液泡内存储。因此,VTC作为一种特殊的膜蛋白质机器,它同时具备受体、酶和转运体的功能。然而,VTC如何耦联信号感知、产物合成与跨膜转运,这种新颖的工作机制尚不清楚。
近日,湖北洪山实验室、作物遗传改良全国重点实验室蛋白质科学研究团队的蛋白质动态学课题组在Nature Communications在线发表题为The cytoplasmic synthesis and coupled membrane translocation of eukaryotic polyphosphate by signal-activated VTC complex的研究论文,解析了VTC复合物激活态(结合PP-InsP信号分子)的冷冻电镜结构,并阐明了VTC的工作机制,为polyP合成和跨膜转运的耦合机制提供了新的见解。
结构显示,VTC复合物按照Vtc1:Vtc3:Vtc4=3:1:1的化学计量比形成异源五聚体,共具有15个跨膜螺旋,其中每个亚基的TM1参与膜通道的组装(图1)。亚基Vtc3的SPX与TTM结构域位于膜外胞质区,远离跨膜通道;亚基Vtc4的SPX与TTM结构域位于Vtc3与跨膜结构域之间,形成类似三明治的整体结构。
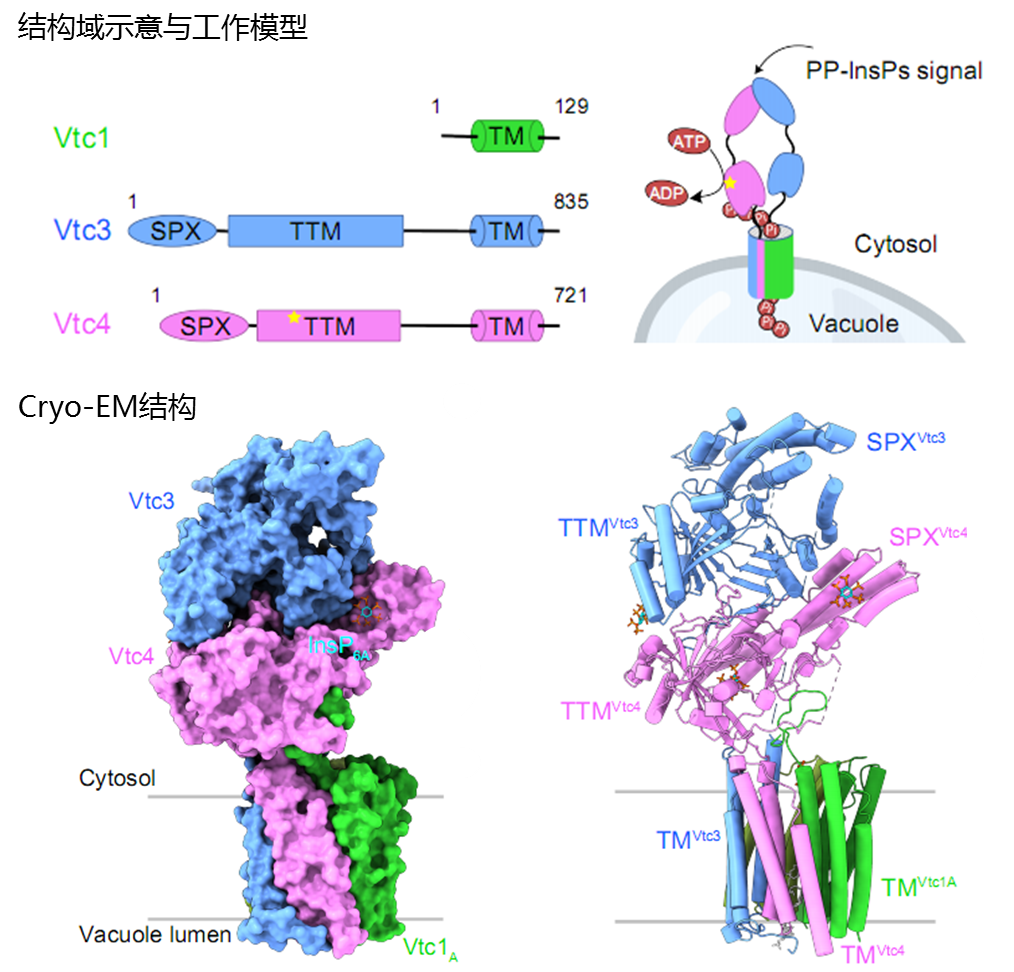
图1. VTC复合物的结构
VTC复合物中,Vtc3和Vtc4都具有PP-InsP信号受体结构域(SPX domain),已有研究猜测两者都是PP-InsP的受体。而在该研究中,作者发现PP-InsP只是特异性的结合在SPXVtc4,而非SPXVtc3,提示只有SPXVtc4发挥感知PP-InsP信号的功能。进一步,作者通过功能分析,研究揭示了VTC复合物中PP-InsP的真实受体是SPXVtc4。
研究发现,polyP的合成结构域TTMVtc4靠近跨膜通道TM,TTMVtc4的开口朝向TM的入口,且TTMVtc4-TMs之间具有一条连续的正电富集带(图2)。作者在该区域发现了两个磷酸根分子的密度,结合生化和功能分析,作者确认了关键氨基酸残基,揭示该正电富集带是新鲜合成的polyP进入跨膜通道的路径。
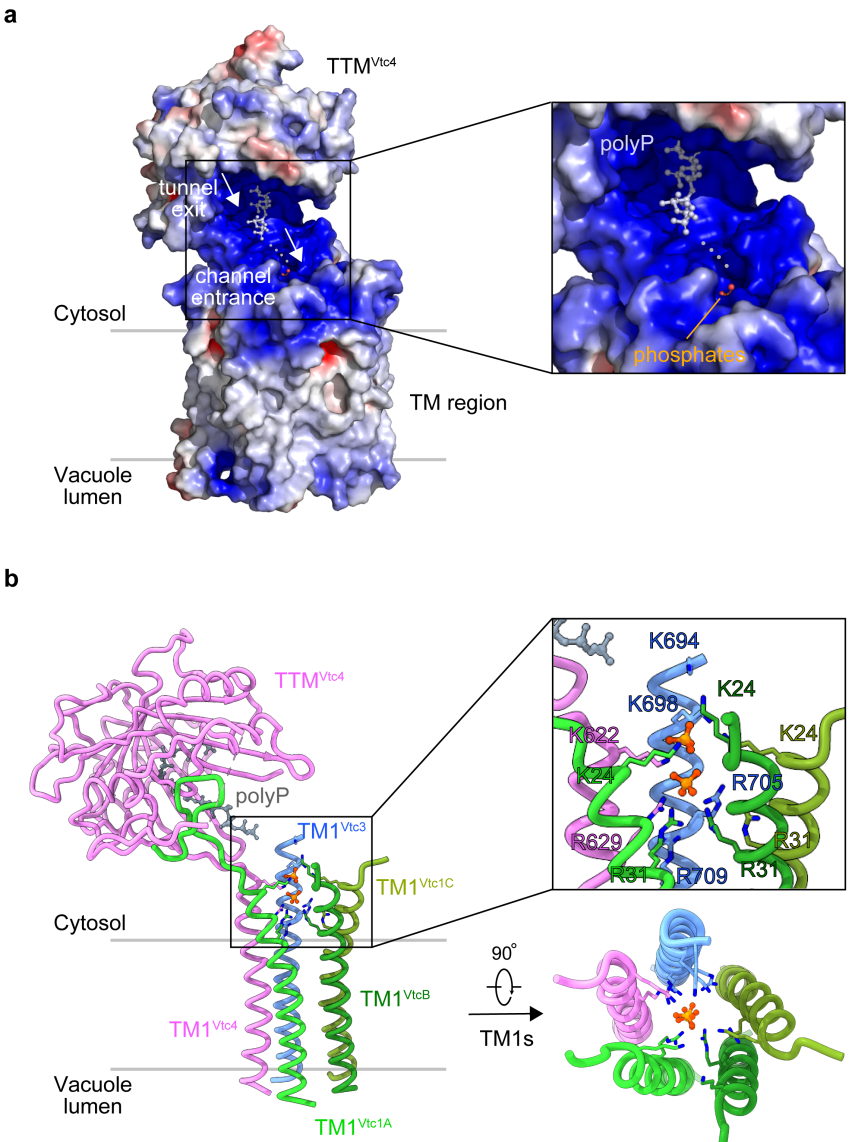
图2. polyP合成与转运的空间耦联
基于此,作者使用in-cell NMR技术直接检测活酵母内的polyP,在原位表征和分析了VTC的功能(图3a)。作者发现,VTC跨膜通道内部的碱性氨基酸对于polyP的合成与转运至关重要,它们负责将新鲜合成的polyP从合成结构域“拉出来”,并将其“拉入”跨膜通道进行转运,实现polyP合成与转运的时空耦联。此外,作者运用smFRET技术,在单分子水平研究了VTC感知PP-InsP信号后结构的动态变化(图3b)。研究发现,PP-InsP作为信号分子,它结合Vtc4,通过别构调控,诱导VTC的构象发生变化,使polyP的合成结构域向跨膜通道靠近,VTC从抑制态转变为激活态,开启polyP的合成与转运。基于此,作者联合in-cell NMR与smFRET技术鉴定和分析了别构调控的关键氨基酸和作用区段。
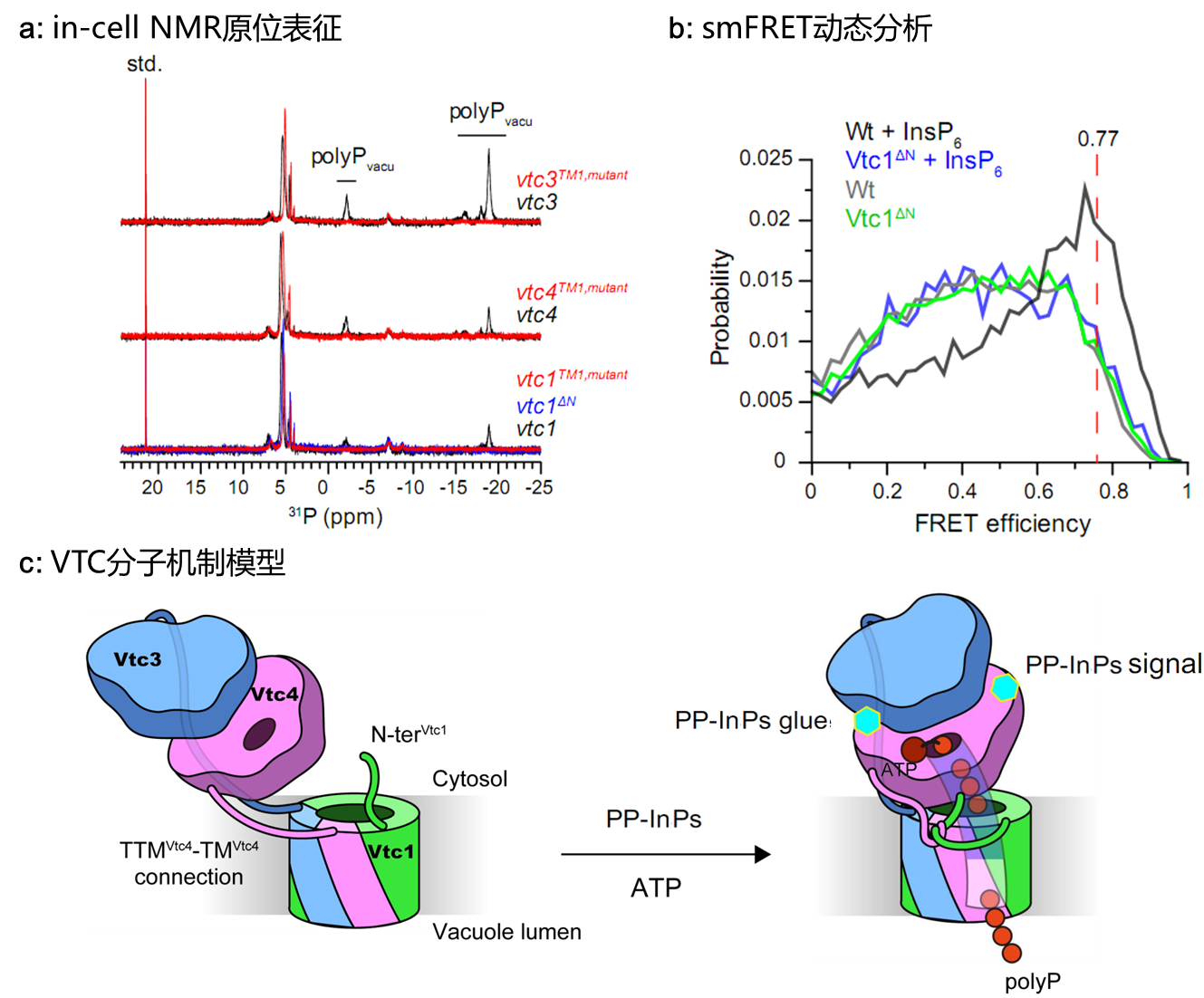
图3. VTC执行功能的分子机制与动态过程
综上,研究者采用整合结构生物学方法,联合使用cryo-EM,in-cell NMR,smFRET等多种生物物理技术,揭示了VTC复合物耦联信号感知、产物合成与跨膜转运的分子机制(图3c),为理解真核生物中polyP的生物发生提供了新的见解,也为其他高等生物中polyP合酶的发现提供了线索和指导。
官泽源博士,研究生陈娟,刘瑞文,中科院精密测量科学与技术创新研究院陈艳可博士,湖北大学邢琼教授为论文共同第一作者,刘主教授为论文通讯作者,该研究受到了国家重点研发计划、国家自然科学基金等项目的资助。华中农业大学校级蛋白质平台和电镜中心对该工作提供了帮助,中国科学技术大学冷冻电镜中心与高永翔博士为电镜数据收集提供了有力支撑。
审核:刘主